近日,国际顶级期刊《美国化学会杂志》(J. Am. Chem. Soc)在线刊发了云顶7610官网登录吴钰周教授的最新研究成果“Chemogenetic Evolution of Diversified Photoenzymes for Enantioselective [2 + 2] Cycloadditions in Whole Cells” (DOI: 10.1021/jacs.4c03087)。

酶是绿色、高效的生物催化剂,其三维超分子空腔为有机反应的精确选择性控制提供了一个天然的手性环境,在处理光化学反应中生成的高活性、短寿命的自由基中间体时,这种优势尤为明显。然而,自然界中的天然光酶种类十分稀缺且催化性能专一性较强,难以满足当前不对称光催化合成的需求。随着基因工程、蛋白质工程等生物技术的发展,通过将合成化学发展的光催化剂和光催化机制融合到天然蛋白骨架中构建新型人工光酶,极大地拓展了光生物催化的反应类型和应用范围。近来,吴钰周教授团队基于基因密码子扩展技术将二苯甲酮非天然氨基酸引入至蛋白骨架中构建三重态手性人工光酶的研究,成功展示了人工光酶在不对称光生物转化方面的应用潜力(Nature, 2022, 611, 715),但基因密码子拓展技术仅适用于构建含特定光敏基团的人工光酶,难以用于高效地筛选大量不同的光敏基团,对引入过渡金属或者结构复杂的有机光敏基团也有较大挑战。相较之下,蛋白质化学修饰技术可以将不同类型的有机光敏剂定点引入至蛋白骨架中发展多样性的人工光酶,但由于难以结合高通量的定向进化过程,至今尚未应用于不对称催化领域。
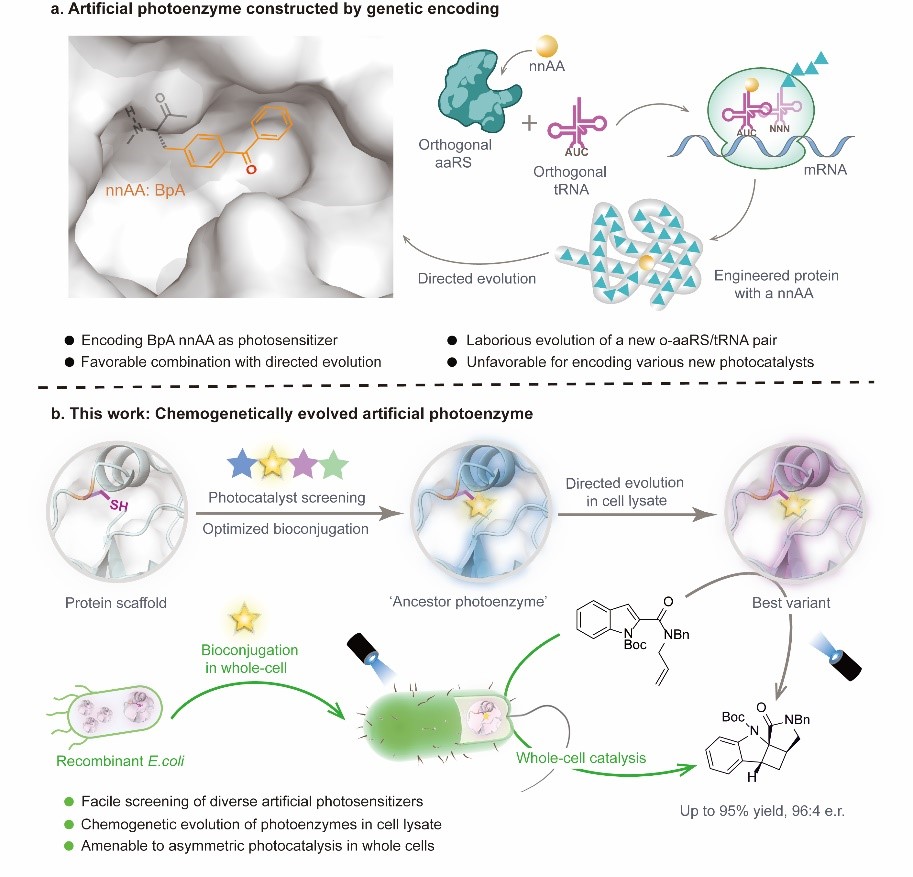
在本文中,吴钰周教授团队提出了一种蛋白质化学遗传修饰的方法,适用于构建结构、性质以及功能各异的手性人工光酶,为激发态光反应的手性控制难题提供了新的解决方案。团队首先利用蛋白半胱氨酸巯基官能团较强的亲核性,将合成化学发展的各类高效有机光敏剂定点插入到选定蛋白的手性空腔中,构建了化学修饰的人工光酶酶库CMP。由于这类有机光敏剂均具有优异的三重态光物理性质且发色团吸收范围涵盖广,该光酶酶库能够在不同工作波长下催化底物从分子基态跃迁到激发态发生光反应,其中含噻吨酮光敏中心的CMP1.0被鉴定为催化紫外敏感型底物2-羧基酰胺吲哚烯基不对称[2+2]光环加成反应的最佳初代人工光酶。
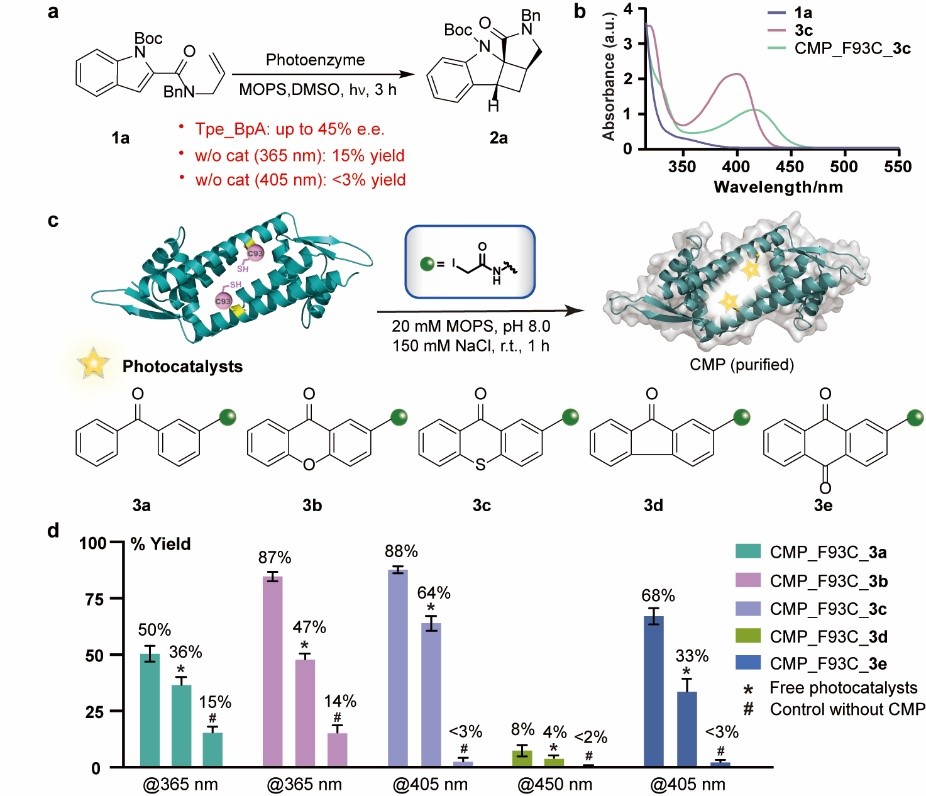
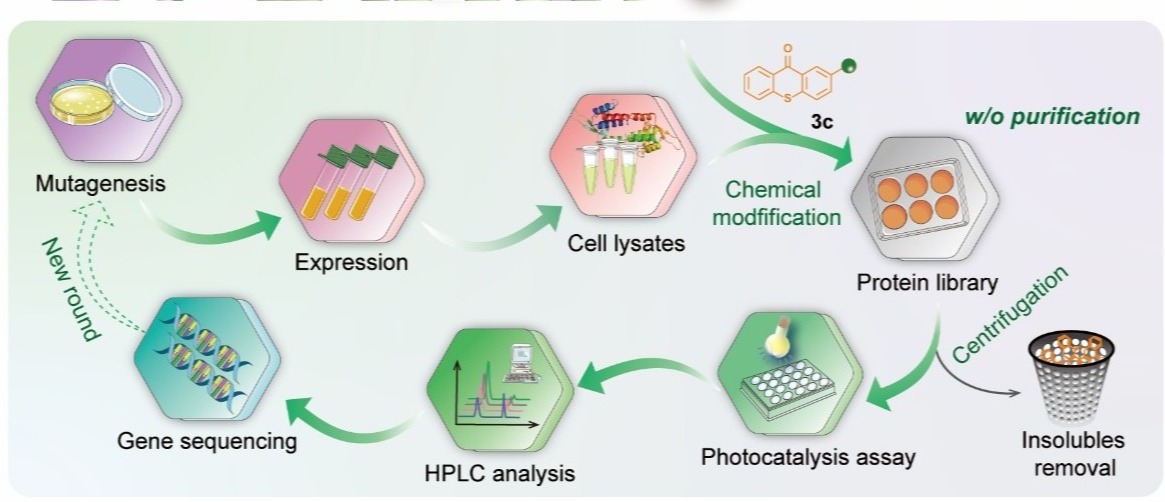
通过探究和优化化学修人工光酶的高效定向进化方法,团队建立了可以基于细胞裂解液进行蛋白质定点化学修饰的突变体筛选流程,无需经过分离纯化,即可进行高通量定向进化。最终经四轮突变迭代优化CMP1.0的氨基酸残基和反应空腔结构,获得具有优异催化性能的突变体CMP4.0,该人工光酶能够高效催化烯基吲哚分子内[2+2]光环加成反应,所获得的环丁烷吲哚啉产物具有较好的底物普适性和优异的对映选择性(最高可以获得96:4 e.r.值)。经CMP4.0晶体结构解析及计算辅助蛋白质模拟分析,阐明了反应优异的对映选择性来源于光敏基团和周边关键氨基酸残基与底物之间形成的π-π堆积等多重弱键协同作用。
基于CMP4.0优异催化性能及可见光吸收特性,团队进一步使用表达CMP4.0的重组大肠杆菌细胞探索了全细胞光生物催化,实现了化学遗传修饰法构建的人工光酶于胞内催化高效对映选择性光环加成反应,是人工光酶在全细胞不对称光催化方向的突破性进展,展示了基于化学遗传修饰法构建人工光合成细胞的可能。这项研究发展了高效的人工光酶构建策略,将从根本上丰富人工光酶的种类,为解决能量转移不对称光催化反应中的手性控制难题以及拓宽不对称光生物催化反应性提供了新的方案,也为发展其他含非天然辅因子的新型高效人工光酶提供了研究基础。
云顶7610官网登录吴钰周教授为本文通讯作者。云顶7610官网登录2020级博士研究生郭娟为论文第一作者,华中科技大学为唯一通讯单位。该研究工作得到了国家重点研发计划项目(2018YFA0903500)资助。
